 Os cientistas inseriram um gene para um receptor de luz verde nos olhos de ratos cegos e, um mês depois, os ratos estavam navegando em torno de obstáculos tão facilmente quanto aqueles sem problemas de visão.
Os cientistas inseriram um gene para um receptor de luz verde nos olhos de ratos cegos e, um mês depois, os ratos estavam navegando em torno de obstáculos tão facilmente quanto aqueles sem problemas de visão.
Os ratos podiam ver movimento, mudanças de brilho em uma faixa de mil vezes e detalhes finos em um iPad eram suficientes para distinguir letras.
Os pesquisadores dizem que, em menos de três anos, a terapia genética - que eles forneceram através de um vírus inativo - poderia ser testada em humanos que perderam a visão por causa da degeneração da retina, idealmente dando-lhes visão suficiente para se movimentar e potencialmente restaurando sua capacidade de ler ou assistir a um vídeo.
"Você injetaria esse vírus no olho de uma pessoa e, alguns meses depois, estaria vendo algo", diz Ehud Isacoff, professor de biologia molecular e celular da Universidade da Califórnia, em Berkeley, e diretor da Helen Wills. Instituto de Neurociência.
“… Quão maravilhoso seria para as pessoas cegas recuperarem a capacidade de ler um monitor de computador padrão, se comunicar por vídeo, assistir a um filme.”
“Com as doenças neurodegenerativas da retina, muitas vezes todas as pessoas tentam interromper ou retardar a degeneração. Mas algo que restaura uma imagem em poucos meses - é uma coisa incrível de se pensar. ”
Cerca de milhões de pessoas no mundo vivem com degeneração macular relacionada à idade, que atinge um em 170 pessoas com mais de 10, enquanto 55 milhões de pessoas em todo o mundo têm a forma mais comum de cegueira hereditária, retinite pigmentosa, que normalmente deixa as pessoas cegas pela idade de 1.7.
"Eu tenho amigos sem percepção de luz, e seu estilo de vida é de cortar o coração", diz John Flannery, professor de biologia molecular e celular que faz parte do corpo docente da Faculdade de Optometria.
“Eles têm que considerar o que as pessoas com visão têm como certo. Por exemplo, toda vez que eles vão para um hotel, o layout de cada sala é um pouco diferente, e eles precisam de alguém para andar pela sala enquanto eles constroem um mapa 3D em sua cabeça. Objetos do cotidiano, como uma mesa de centro baixa, podem ser um risco de queda. O ônus da doença é enorme entre pessoas com perda de visão grave e incapacitante, e elas podem ser as primeiras candidatas a esse tipo de terapia ”.
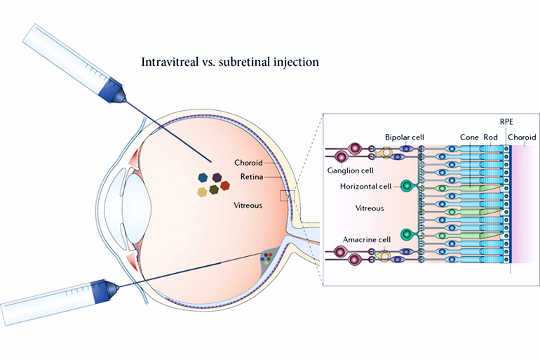 A nova terapia envolve injetar vírus inativados no vítreo para transportar um gene diretamente para as células ganglionares. Versões anteriores da terapia viral exigiam a injeção do vírus sob a retina (parte inferior). (Crédito: John Flannery)
A nova terapia envolve injetar vírus inativados no vítreo para transportar um gene diretamente para as células ganglionares. Versões anteriores da terapia viral exigiam a injeção do vírus sob a retina (parte inferior). (Crédito: John Flannery)
Atualmente, as opções para esses pacientes são limitadas a um implante de olho eletrônico conectado a uma câmera de vídeo que fica em um par de óculos - uma configuração desajeitada, invasiva e dispendiosa que produz uma imagem na retina equivalente a algumas centenas píxeis. Visão nítida e normal envolve milhões de pixels.
Corrigir o defeito genético responsável pela degeneração da retina também não é simples, porque existem mais de 250 diferentes mutações genéticas responsáveis pela retinite pigmentosa sozinha. Cerca de 90 por cento destes matam as células fotorreceptoras da retina - as hastes, sensíveis à luz fraca, e os cones, para a percepção da cor da luz do dia. Mas a degeneração da retina tipicamente poupa outras camadas de células da retina, incluindo as células ganglionares bipolares e retinianas, que podem permanecer saudáveis, embora insensíveis à luz, por décadas depois que as pessoas se tornam totalmente cegas.
Em seus ensaios em camundongos, os pesquisadores conseguiram tornar o 90% de células ganglionares sensíveis à luz.
Um sistema simples
Para reverter a cegueira nesses camundongos, os pesquisadores projetaram um vírus direcionado às células ganglionares da retina e o carregaram com o gene para um receptor sensível à luz, a opsina de cone verde (comprimento de onda médio). Normalmente, apenas as células fotorreceptoras do cone expressam esta opsina e as tornam sensíveis à luz verde-amarela. Quando os pesquisadores injetavam no olho, o vírus carregava o gene em células ganglionares, que normalmente são insensíveis à luz, e as tornava sensíveis à luz e capazes de enviar sinais ao cérebro que ele interpretava como visão.
"Para os limites que podemos testar os ratos, você não pode dizer o comportamento dos camundongos tratados optogeneticamente a partir dos ratos normais, sem equipamento especial", diz Flannery. "Resta ver o que isso significa em um paciente".
Em camundongos, os pesquisadores entregaram as opsinas à maioria das células ganglionares da retina. Para tratar humanos, eles precisariam injetar muito mais partículas virais, porque o olho humano contém milhares de vezes mais células ganglionares do que o olho do rato. Mas a equipe desenvolveu os meios para melhorar a entrega viral e espera inserir o novo sensor de luz em uma porcentagem similarmente alta de células ganglionares, uma quantidade equivalente aos números muito altos de pixels em uma câmera.
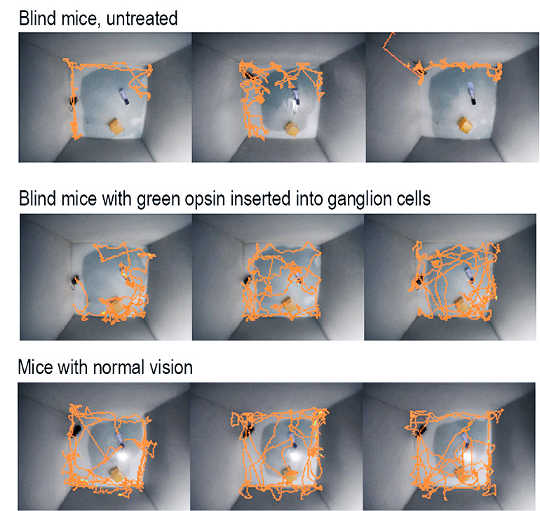 As linhas laranja acompanham o movimento dos ratos durante o primeiro minuto depois que os pesquisadores os colocaram em uma jaula estranha. Camundongos cegos (em cima) cautelosamente mantêm-se nos cantos e lados, enquanto os camundongos tratados (no meio) exploram a gaiola quase tanto quanto os ratos com visão normal (abaixo). (Crédito: Ehud Isacoff / John Flannery)
As linhas laranja acompanham o movimento dos ratos durante o primeiro minuto depois que os pesquisadores os colocaram em uma jaula estranha. Camundongos cegos (em cima) cautelosamente mantêm-se nos cantos e lados, enquanto os camundongos tratados (no meio) exploram a gaiola quase tanto quanto os ratos com visão normal (abaixo). (Crédito: Ehud Isacoff / John Flannery)
Isacoff e Flannery encontraram a solução simples depois de mais de uma década tentando esquemas mais complicados, incluindo a inserção em combinações sobreviventes de células da retina de receptores de neurotransmissores geneticamente modificados e interruptores químicos sensíveis à luz. Estes funcionaram, mas não atingiram a sensibilidade da visão normal. Opsinas de micróbios testados em outros locais também apresentaram menor sensibilidade, exigindo o uso de óculos de amplificação de luz.
Para capturar a alta sensibilidade da visão natural, os pesquisadores se voltaram para as opsinas receptoras de luz das células fotorreceptoras. Usando um vírus adeno-associado que naturalmente infecta células ganglionares, eles entregaram com sucesso o gene para uma opsina da retina no genoma das células ganglionares. Os ratos anteriormente cegos adquiriram visão que durou a vida inteira.
“Esse sistema funciona é muito, muito satisfatório, em parte porque também é muito simples”, diz Isacoff. "Ironicamente, você poderia ter feito isso 20 anos atrás."
Os pesquisadores estão levantando fundos para levar a terapia genética a um teste em humanos dentro de três anos. Sistemas de liberação de AAV similares foram aprovados pelo FDA para doenças oculares em pessoas com condições de retina degenerativa e que não têm alternativa médica.
Desafiando as probabilidades
De acordo com Flannery e Isacoff, a maioria das pessoas no campo da visão questionaria se as opsinas poderiam funcionar fora de suas células fotorreceptoras especializadas. A superfície de um fotorreceptor é decorada com opsinas - rodopsina em bastões e opsinas vermelhas, verdes e azuis em cones - embutidos em uma complicada máquina molecular. Um relé molecular - a cascata de sinalização do receptor acoplado à proteína G - amplifica o sinal tão efetivamente que somos capazes de detectar fótons únicos de luz.
Um sistema de enzimas recarrega a opsina uma vez que detecta o fóton e se torna “branqueada”. A regulação de feedback adapta o sistema a brilhos de fundo muito diferentes. E um canal iônico especializado gera um sinal de tensão potente. Sem transplantar todo esse sistema, era razoável suspeitar que a opsina não funcionaria.
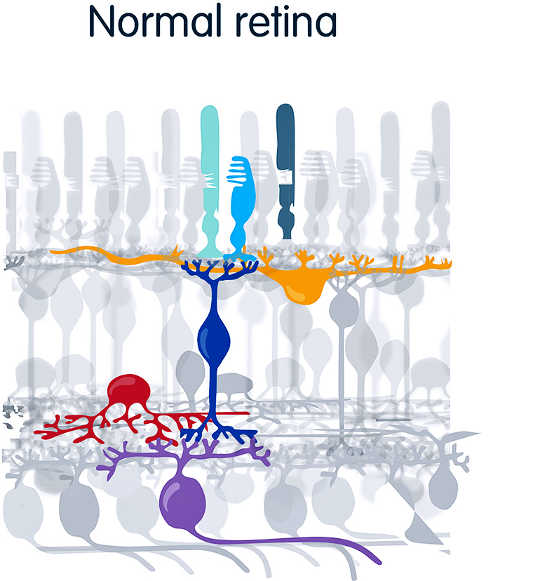 Em uma retina normal, os fotorreceptores - bastonetes (azuis) e cones (verdes) - detectam a luz e transmitem sinais para outras camadas do olho, terminando nas células ganglionares (púrpura), que falam diretamente com o centro da visão do cérebro. (Crédito: UC Berkeley)
Em uma retina normal, os fotorreceptores - bastonetes (azuis) e cones (verdes) - detectam a luz e transmitem sinais para outras camadas do olho, terminando nas células ganglionares (púrpura), que falam diretamente com o centro da visão do cérebro. (Crédito: UC Berkeley)
Mas Isacoff, especialista em receptores acoplados à proteína G no sistema nervoso, sabia que muitas dessas partes existem em todas as células. Ele suspeitava que uma opsina se conectaria automaticamente ao sistema de sinalização das células ganglionares da retina. Juntos, ele e Flannery inicialmente tentaram a rodopsina, que é mais sensível à luz do que as opsinas do cone.
Para sua satisfação, quando introduziram a rodopsina nas células ganglionares de camundongos cujos cones e bastonetes haviam degenerado completamente, e que eram consequentemente cegos, os animais recuperaram a capacidade de distinguir a escuridão da luz - até da luz fraca do quarto. Mas a rodopsina mostrou-se lenta demais e falhou no reconhecimento de imagens e objetos.
Eles então tentaram o cone verde opsin, que respondeu 10 vezes mais rápido que a rodopsina. Notavelmente, os ratos foram capazes de distinguir linhas paralelas de horizontais, linhas espaçadas de perto versus amplamente espaçadas (uma tarefa de acuidade humana padrão), linhas móveis versus linhas estacionárias. A visão restaurada era tão sensível que os iPads poderiam ser usados para as exibições visuais, em vez de LEDs muito mais brilhantes.
"Isso trouxe poderosamente a mensagem para casa", diz Isacoff. "Afinal, como seria maravilhoso para os cegos recuperarem a capacidade de ler um monitor de computador padrão, se comunicar por vídeo, assistir a um filme".
Esses sucessos fizeram Isacoff e Flannery querer dar um passo adiante e descobrir se os animais poderiam navegar no mundo com visão restaurada. Surpreendentemente, também aqui, a operação do cone verde foi um sucesso. Os ratos que tinham sido cegos recuperaram sua capacidade de realizar um dos seus comportamentos mais naturais: reconhecer e explorar objetos tridimensionais.
Eles então fizeram a pergunta: “O que aconteceria se uma pessoa com visão restaurada fosse ao ar livre para uma luz mais brilhante? Estariam cegados pela luz? ”Aqui, outra característica marcante do sistema surgiu, Isacoff diz: A via de sinalização do opsin do cone verde se adapta. Animais previamente cegos se ajustavam à mudança de brilho e podiam executar a tarefa tão bem quanto animais avistados. Essa adaptação funcionou ao longo de cerca de mil vezes - a diferença, essencialmente, entre a iluminação média interna e a externa.
"Quando todo mundo diz que nunca vai funcionar e que você é louco, geralmente isso significa que você está em algo", diz Flannery. Na verdade, isso equivale à primeira restauração bem-sucedida da visão padronizada usando uma tela de computador LCD, a primeira a se adaptar às mudanças na luz ambiente e a primeira a restaurar a visão natural do objeto.
A pesquisa aparece em Natureza das Comunicações. A equipe está agora no trabalho testando variações sobre o tema que poderiam restaurar a visão das cores e aumentar ainda mais a acuidade e a adaptação. O Instituto Nacional do Olho dos Institutos Nacionais de Saúde, o Centro de Desenvolvimento da Nanomedicina para o Controle Óptico da Função Biológica, a Fundação para a Luta contra a Cegueira, a Fundação Esperança para a Visão e o Instituto de Pesquisa Médica Lowy apoiaram a pesquisa.
Fonte: UC Berkeley
Livros relacionados
at InnerSelf Market e Amazon






















